Dans les articles phares du CRBLM, nous soulignons le travail actuel et en cours de nos membres sur divers sujets.
Oiseaux chanteurs et singes qui signent : ce que les animaux peuvent nous dire sur l'ouïe, la parole et la musique
Traduction par Audrey Delcenserie
Au CRBLM, les études portant sur le traitement auditif se concentrent habituellement sur les humains. Cependant, pour cet article, nous présenterons des études portant sur d’autres animaux et nous tenterons de déterminer comment ces animaux se comparent aux humains !
La parole et la musique sont des regroupements de nombreuses capacités auditives et motrices. Pour mieux comprendre l’évolution de ces capacités, nous devons comparer plusieurs espèces afin de déterminer lesquelles possèdent ces capacités et lesquelles ne les possèdent pas. C’est ce qu’on appelle l’approche comparative.
Bien sûr, en termes de traitement auditif, nous partageons certaines capacités de base avec de nombreux animaux. Le cortex auditif primaire étant bien conservé dans toutes les espèces, les chercheurs du laboratoire de Villers-Sidani ont pu se tourner vers le cortex auditif du rat pour comprendre les périodes critiques du développement de la perception auditive. Cisneros-Franco et ses collègues ont récemment démontré que le maintien des perceptions stables du son serait effectué par un type spécial de neurone (des neurones positifs à la parvalbumine). En inactivant ces neurones, le cortex auditif des rats est revenu à un état plus jeune et plus flexible. Étant donné la similitude du cortex auditif dans beaucoup d’espèces, il est probable que ce type de cellule ait une fonction similaire dans le cerveau humain : solidifier l’expérience acquise en grandissant.
Une autre manière d’examiner les processus fondamentaux du traitement du son est de mesurer la réponse soutenue en fréquence, ou FFR (pour Frequency Following Response). La FFR est un signal électrique qui est généré par des neurones et qui se verrouille sur la fréquence fondamentale ou la hauteur tonale – entre autres aspects d’un stimulus. Elle est liée à la perception de la hauteur et même à la synchronisation rythmique. Ayala et ses collègues ont démontré que les singes rhésus ont une FFR similaire à celle des humains, démontrant encore que le traitement du son peut être similaire chez différentes espèces.
Mais, qu’en est-il des capacités plus complexes ? Dans une récente revue de littérature portant sur le rythme de la parole et de la musique, Ravignani et ses collègues ont fait la promotion de l’approche comparative. Ils mentionnent qu’un certain nombre d’espèces possèdent des comportements auditifs et moteurs complexes. Certaines espèces, comme les cacatoès et les otaries, peuvent se synchroniser de manière flexible à un rythme et ajuster leurs mouvements aux différentes vitesses d’un métronome. Beaucoup de ces espèces affichent également un apprentissage vocal : une capacité à imiter les sons émis par d’autres animaux ou par l’environnement. D’autre part, les vocalisations d’espèces comme l’orque et le phoque commun possèdent une structure hiérarchique – autrement dit, leurs vocalisations sont faites de motifs récurrents et imbriqués, comme le langage humain !
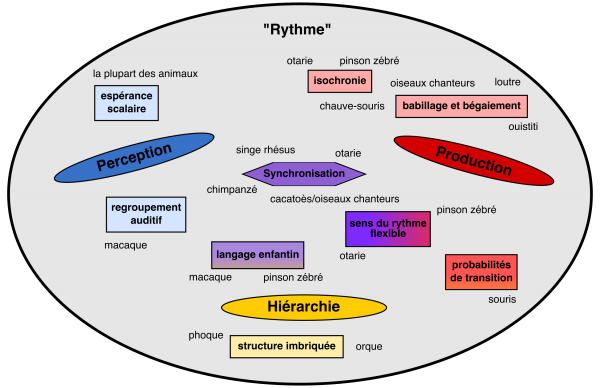
Certaines des habiletés motrices auditives pouvant être considérées sous le terme générique de « rythme » et les noms de certains animaux qui se sont avérés posséder ces habiletés. Basé sur Ravignani et ses collègues.
Les caractéristiques de l’apprentissage vocal, de la synchronisation à un rythme et de la structure hiérarchique sont réparties entre les espèces – et ce n’est pas parce qu’une espèce possède une caractéristique qu’elle les possède tous. Le fait que ces capacités semblent être présentes dans différentes branches de l’arbre de l’évolution (ou arbre phylogénétique) suggère qu’elles peuvent résulter d’une évolution convergente (i.e. lorsqu’un comportement évolue plusieurs fois en raison de son utilité dans certaines situations de survie).
Les études sur les oiseaux chanteurs sont instructives à cet égard. Ils démontrent que leurs chansons ont un certain nombre de caractéristiques en commun avec la parole humaine, et ce malgré leur distance évolutive par rapport à nous. Dans la nature, les jeunes pinsons zébrés apprennent des chansons en écoutant des mâles adultes, appelés tuteurs. Cependant, James et Sakata ont récemment élevé des oiseaux sans tuteurs et ont plutôt joué des séquences aléatoires de « syllabes » de pinsons zébrés sur un haut-parleur au cours de leurs années d’apprentissage. Malgré ce tutorat aléatoire, en grandissant, les pinsons se sont mis à produire des séquences qui ressemblaient à celles des pinsons qui évoluent en milieu naturel. Le fait que les pinsons zébrés se soient installés sur un ordre de syllabes spécifiques, quelle que soit leur méthode d’apprentissage, peut représenter des contraintes biologiques, ou bien des contraintes liées à l’apprentissage de la chanson des pinsons zébrés. Certaines des caractéristiques de ces chaînes de syllabes s’appliquent également à la parole et à la musique humaines, comme l’allongement d’une syllabe à la fin d’une phrase ou l’arc de hauteur d’une mélodie.
Le chant du pinson zébré partage beaucoup de ses caractéristiques avec la parole humaine. Toutefois, chez les oiseaux chanteurs, il existe d’importantes différences entre mâles et femelles. Les mâles sont les « interprètes » qui chantent afin d’attirer une partenaire. Les femelles ne chantent pas; elles sont les « juges » qui choisissent leur compagnon en fonction de la qualité de son chant. Dans une étude impressionnante utilisant l’IRMf sur de petits animaux, Van Ruijssevelt et ses collègues ont identifié deux nouvelles régions impliquées dans l’évaluation des chants d’oiseaux par les pinsons zébrés femelles. Dans l’IRM, ils ont joué deux types de chants à des pinsons zébrés femelles : des chants de parades nuptiales destinés aux femelles et d’autres chants interprétés par les mâles lorsqu’ils sont seuls. Les chercheurs ont constaté que le mésopallium caudomédial droit et le nidopallium caudocentral gauche des femelles répondaient davantage au chant de parades nuptiales.
Des tests supplémentaires ont indiqué que le nidopallium caudocentral gauche réagirait de façon plus sélective aux chants destinés aux femelles, tandis que le mésopallium caudomédial droit réagirait simplement aux aspects acoustiques du chant. Bien que les femelles ne chantent pas lors de la parade nuptiale, ces dernières ont tout de même besoin d’un traitement auditif hautement développé afin de générer une réponse appropriée au chant du mâle.
Plus proche de nous sur l’arbre de l’évolution, Loh et ses collègues du laboratoire de Petrides ont examiné la littérature afin de démontrer que la plupart des primates non-humains possèdent l’architecture neuronale normalement associée au contrôle vocal, à l’exception du larynx (la structure dans notre gorge qui contient les cordes vocales). Chez l’homme, le larynx est contrôlé plus directement. Il reçoit des commandes de l’aire motrice supplémentaire ainsi que des aires préfrontales prémotrices et ventrolatérales (voir l’image ci-dessous). Cela signifie que nous pouvons apprendre à l’utiliser de manière flexible pour créer des séquences vocales précises. En revanche, chez les autres primates, le contrôle du larynx passe par un point relais appelé « substance grise périaqueductale ». Plutôt que d’être soumise à un contrôle cognitif spécifique, la substance grise périaqueductale est moins précise et est davantage liée aux vocalisations émotionnelles ou aux cris innés.
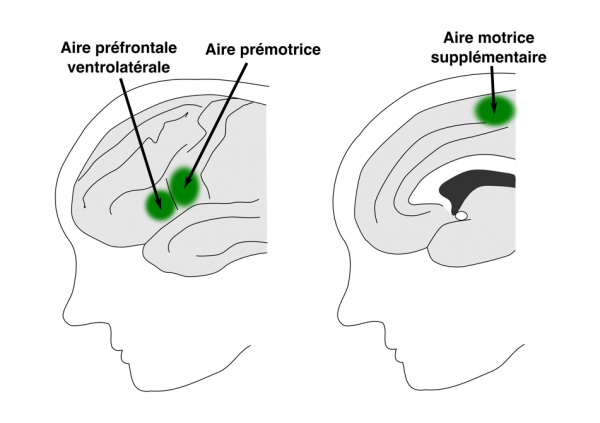
Les domaines impliqués dans le contrôle du larynx chez l’homme. À gauche, la surface extérieure du cerveau est représentée. À droite, une image du cerveau divisée au milieu. Graphique basé sur Loh et collègues.
Les histoires de singes qui ont été élevés par des chercheurs, comme Koko, Kanzi et Washoe, s’harmonisent bien avec ces résultats. Ces singes ne sont pas capables de parler, peut-être à cause des différences de contrôle du larynx mentionnées précédemment, entre autres limitations physiologiques. Ils démontrent cependant une aptitude à apprendre des mots en langue des signes. En d’autres termes, leurs habiletés de communication sont plus avancées que ce qui pourrait être déduit de leur capacité à parler. Ainsi, se demander si les animaux sont dotés de la parole et se demander s’ils peuvent communiquer sont deux questions bien distinctes.
Le voyage vers la compréhension de l’audition et de la communication animale est très instructif. Il nous oblige à nous poser de meilleures questions, à repenser nos définitions et à décentrer l’humain dans l’arbre de l’évolution. Plus de découvertes sont à venir !
References
Cisneros-Franco, J. M., & de Villers-Sidani, É. (2019). Reactivation of critical period plasticity in adult auditory cortex through chemogenetic silencing of parvalbumin-positive interneurons. Proceedings of the National Academy of Sciences, 116(52), 26329–26331. https://doi.org/10.1073/pnas.1913227117
Ayala, Y. A., Lehmann, A., & Merchant, H. (2017). Monkeys share the neurophysiological basis for encoding sound periodicities captured by the frequency-following response with humans. Scientific Reports, 7. https://doi.org/10.1038/s41598-017-16774-8
Ravignani, A., Dalla Bella, S., Falk, S., Kello, C. T., Noriega, F., & Kotz, S. A. (2019). Rhythm in speech and animal vocalizations: a cross-species perspective. Annals of the New York Academy of Sciences, 1–20. https://doi.org/10.1111/nyas.14166
James, L. S., & Sakata, J. T. (2017). Learning Biases Underlie “Universals” in Avian Vocal Sequencing. Current Biology, 27(23), 3676-3682.e4. https://doi.org/10.1016/j.cub.2017.10.019
Van Ruijssevelt, L., Chen, Y., von Eugen, K., Hamaide, J., De Groof, G., Verhoye, M., Güntürkün, O., Woolley, S.C., & Van der Linden, A. (2018). fMRI Reveals a Novel Region for Evaluating Acoustic Information for Mate Choice in a Female Songbird. Current Biology, 28(5), 711-721.e6. https://doi.org/10.1016/j.cub.2018.01.048
Loh, K. K., Petrides, M., Hopkins, W. D., Procyk, E., & Amiez, C. (2017). Cognitive control of vocalizations in the primate ventrolateral-dorsomedial frontal (VLF-DMF) brain network. Neuroscience and Biobehavioral Reviews, 82, 32–44. https://doi.org/10.1016/j.neubiorev.2016.12.001
